Komunikacja między komórkami jest niezbędna do prawidłowego funkcjonowania organizmu, a jednym ze sposobów jest to, że tak się dzieje, są małe kanały zwane połączeniami szczelin. Kanały te są regulowane przez dwa różne mechanizmy: bramę chemiczną i bramę wrażliwą na napięcie. Ostatnie badanie przeprowadzone przez profesora Camillo Peracchia z University of Rochester, opublikowane w International Journal of Molecular Sciences, bada, w jaki sposób mechanizmy te współpracują ze sobą w celu kontrolowania przepływu informacji między komórkami, oferując nowe spojrzenie na ten złożony proces.
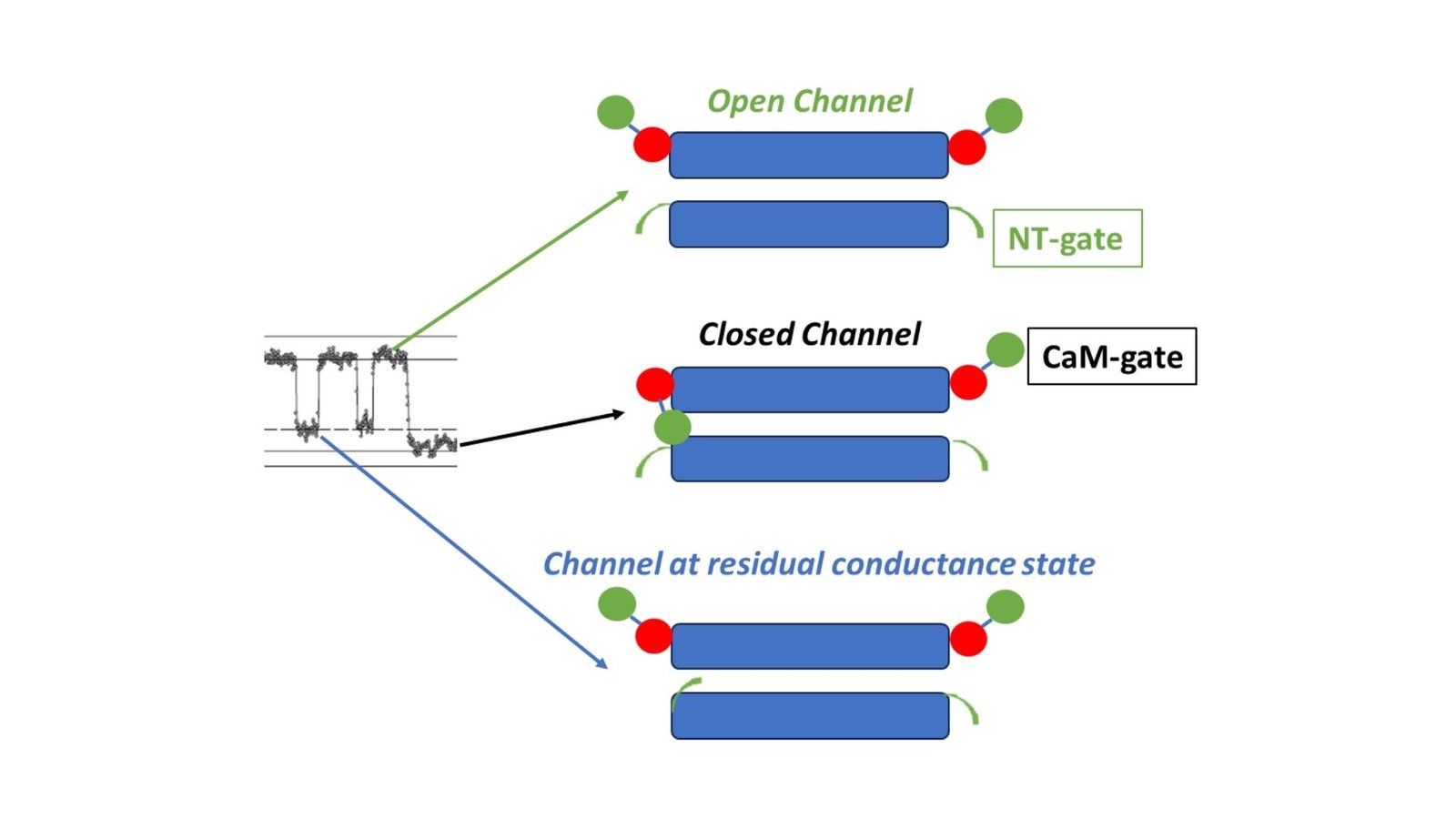
Komórki używają połączeń szczeliny, aby dzielić się ze sobą ważne sygnały i cząsteczki. Kanały te szczególnie reagują na zmiany poziomów wapnia w ogniwach i napięcie elektryczne w błonach komórkowych. Gdy warunki się zmieniają, czynniki te powodują otwarcie kanałów lub zamykające się przez bramę chemiczną lub bramę wrażliwą na napięcie. Badania profesora Peracchia sugerują, że brama chemiczna jest kontrolowana przez białko zwane kalmoduliną, które odgrywa kluczową rolę w wielu aktywności komórkowej. Z drugiej strony brama wrażliwa na napięcie składa się głównie z części białka zwanego domeną NH2-Terminus.
Jak wyjaśnia profesor Peracchia: „Brama chemiczna zamyka się ze zwiększonym poziomem wapnia wewnątrz komórki i określonymi warunkami napięcia w błonie komórkowej”. Oznacza to, że brama chemiczna reaguje powoli, ale całkowicie, zamykając kanał po wykryciu tych specyficznych sygnałów. Tymczasem brama wrażliwa na napięcie działa szybciej, ale nie zamyka w pełni kanału, co czyni mniejsze dostosowanie do tego, ile kanał jest otwarty. Badanie ujawnia również, że sposób reagowania tych bramek może się zmieniać w zależności od konkretnego rodzaju zaangażowanego białka koneksyny, pokazując skomplikowaną równowagę między sygnałami chemicznymi i elektrycznymi w kontrolowaniu tych kanałów.
Profesor Peracchia podkreślił ponadto: „zakwaszenie cytosolowe zmienia się w przeciwne sposoby wrażliwości szybkiego wrażliwego na napięcie bramy: w niektórych przypadkach zwiększa wrażliwość bramki i zmniejsza ją u innych”. Ten podwójny system bramkowania zapewnia, że komórki pozostają w kontaktach w normalnych warunkach, ale mogą szybko odłączyć, jeśli komórka jest pod stresem, na przykład podczas urazu lub gdy poziomy wapnia wzrosną.
Badanie podkreśla ważną rolę kalmoduliny w regulacji połączeń szczeliny, proponując, że płat kalmodulinowy działa jak „korka”, który może podłączyć otwarcie kanału podczas bramkowania chemicznego. Ten model „korka”, jak opisał profesor Peracchia, sugeruje, że na interakcję między kalmoduliną a kanałem wpływają zarówno poziomy wapnia, jak i napięcie, zapewniając podwójną metodę kontroli. Zauważył również: „Kanały połączeń szczeliny mają dwie bramy, które reagują na zmiany w wewnętrznej chemii komórki i środowisku elektrycznym”. Model ten pomaga wyjaśnić, w jaki sposób połączenia GAP dostosowują się do zmian w ciele, z potencjalnymi implikacjami dla opracowania nowych metod leczenia chorób, w których komunikacja komórkowa jest zakłócana.
Ponadto badania omawiają, w jaki sposób te odkrycia mogą wpływać na różne części ciała, w tym serce, wątrobę i mózg, w których znajdują się różne rodzaje białek koneksyny. W badaniu podkreśla, że sposób zachowania kanałów może się różnić w zależności od konkretnych związanych z nimi koneksyn, na które wpływają ich unikalna wrażliwość na sygnały chemiczne i elektryczne.
Wreszcie, badania profesora Peracchia oferują cenne informacje na temat tego, w jaki sposób te podwójne mechanizmy bramkowania w kanałach połączenia szczeliny są starannie regulowane w celu utrzymania właściwej komunikacji między komórkami. Odkrycia otwierają drzwi do przyszłych badań w celu zbadania potencjalnych metod leczenia, które mogłyby dostosować połączenia szczelin w warunkach, w których upośledzona jest komunikacja komórkowa.
Referencje dziennika
Peracchia, C. „Regulacja kanału połączenia szczeliny: opowieść o dwóch bramach – czułość napięcia bramki chemicznej i wrażliwość chemiczna bramki szybkiego napięcia”. International Journal of Molecular Sciences, 2024. DOI: https://doi.org/10.3390/ijms25020982
O autorze

Camillo Perachia jest emerytowanym profesorem farmakologii i fizjologii na University of Rochester. W 1962 r. Otrzymał stopień MD Summa Cum Laude na University of Mediolan (Włochy). Jego badania koncentrowały się na regulacji komunikacji komórkowej za pośrednictwem kanałów połączeń szczelinowych. W 1967 r. Otrzymał amerykańską Radę Edukacyjną ds. Zagranicznych absolwentów medycznych. Opublikował ponad sto artykułów, zredagował trzy książki i autorem dwóch. Był zaproszonym mówcą w ponad czterdziestu międzynarodowych kongresach i sympozjach i był redaktorem naczelnym Journal of Neurocytology. W 1994 r. Został wybrany honorowym członkiem „Societá di Medicina E Scienze Naturali” (University of Parma, Włochy). Pełnił funkcję członka sekcji biologii i fizjologii komórkowej (CBY-1, NIH, 1990-94). Jest członkiem markiza, który jest kim. Nauczał fizjologię oddechową studentom medycyny i biologii komórkowej dla absolwentów. Był dyrektorem kursu Physiology-500 Kurs (1985-88 i 1998-99), dyrektorem sekcji fizjologii oddechowej (1986-99) oraz sekcją fizjologii fizjologii oddechowej w kursie „funkcja struktury człowieka” (2000-04). Za swoje nauczanie otrzymał nagrodę Manuel D. Goldman (1998), Edward F. Adolph Medal (2004) i pięć pochwał.