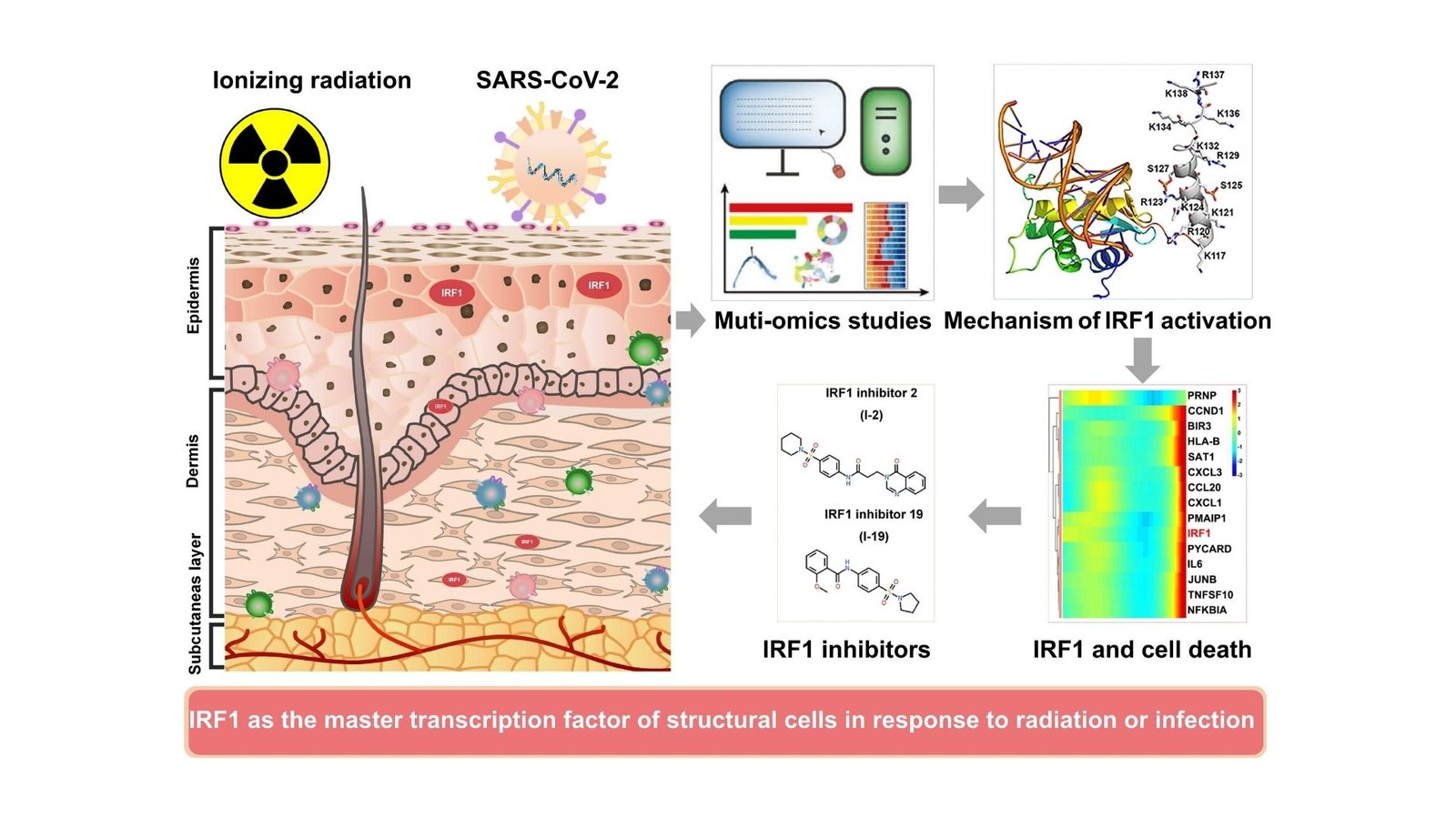
W jaki sposób komórki strukturalne reagują na szkodliwy stres spowodowany promieniowaniem, oferując potencjalne sposoby zmniejszenia szkodliwego stanu zapalnego i śmierci komórek? Naukowcy stwierdzili, że białko IRF1 (współczynnik regulacyjny interferonu 1) staje się aktywny po ekspozycji na promieniowanie, wywołując reakcję łańcuchową, która może pogorszyć uszkodzenie komórek. Znany ze swojej roli we wrodzonej odporności, IRF1 zazwyczaj pomaga organizmowi walczyć z patogenami i komórkami rakowymi. Zespół prowadzony przez profesora Shuyu Zhanga, w tym Fenghao Geng, Jianhui Chen, Bin Song i innych badaczy z Syczuan University i Soochow University, opublikował te odkrycia w zakresie immunologii komórkowej i molekularnej.
Ekspozycja na promieniowanie powoduje znaczne uszkodzenie komórek, co prowadzi do natychmiastowego i długotrwałego stanu zapalnego. W podstawowych narządach barierowych, takich jak skóra, płuca i jelita, komórki strukturalne reagują na ten stres, czasem powodując uszkodzenie tkanki, które rozciągają się z czasem. To badanie podkreśla, w jaki sposób IRF1, białko powszechnie związane z odpowiedziami immunologicznymi, staje się centralnym graczem w tych reakcjach, gdy komórki strukturalne są narażone na promieniowanie. Naukowcy szczegółowo opisują, w jaki sposób promieniowanie aktywuje IRF1, przy wsparciu specyficznych białek pomocniczych i modyfikacji chemicznych, które dopracowują aktywność IRF1 po jego utworzeniu w komórce.
Ostrożne eksperymenty przez zespół badawczy odkryło dokładnie, w jaki sposób promieniowanie wpływa na aktywację i ekspresję IRF1. Stosując precyzyjną technikę do badania RNA w poszczególnych komórkach, odkryli, że ekspozycja na promieniowanie doprowadziła do zwiększonej aktywacji IRF1 w niektórych komórkach skóry, takich jak fibroblasty i keratynocyty. Zaskakujące, że odpowiedź ta ograniczała się raczej do komórek strukturalnych niż komórek odpornościowych, co sugeruje, że rola IRF1 wykracza poza tradycyjne funkcje odpornościowe i może wpływać na nieimmunologiczne typy komórek w znaczący sposób.
Podsumowując, naukowcy zidentyfikowali nowe punkty modyfikacji IRF1, które kontrolują jego aktywność po utworzeniu białka. W szczególności stwierdzili, że acetylacja i fosforylacja w sekwencji lokalizacji jądrowej IRF1 pozwalają jej przejść do jądra komórkowego i inicjować odpowiedzi zapalne. Zmiana tych miejsc sekwencji lokalizacji jądrowej powstrzymała IRF1 przed przejściem do jądra komórkowego, gdzie normalnie rozpocząłby łańcuch odpowiedzi prowadzących do stanu zapalnego i śmierci komórek. Profesor Zhang wyjaśnił: „Dzięki tym odkryciom wykazaliśmy, że ruch jądrowy IRF1 jest niezbędny do wywołania indukowanych promieniowaniem reakcji zapalnych”. To odkrycie sugeruje, że celowanie w te punkty modyfikacji może stanowić nowy sposób zarządzania uszkodzeniem zapalnym związanym z ekspozycją na promieniowanie.
Powtarzające się próby koncentrowały się na tym, jak różne dawki i harmonogram promieniowania wpłynęły na zachowanie IRF1 w czasie. Gdy komórki były wielokrotnie narażone na niskie dawki, naśladując typowy schemat radioterapii, poziomy aktywacji IRF1 stale rosły-efekt nie zaobserwowany przy pojedynczej ekspozycji wysokiej dawki. Ta reakcja związana z dawką sugeruje, że rola IRF1 w zapaleniu może się zmieniać w zależności od rodzaju promieniowania i częstotliwości, wglądu, który może pomóc w opracowaniu projektu leczenia promieniowania i sposobów zmniejszenia jego skutków ubocznych.
Ponadto odpowiedzi zapalne wywołane promieniowaniem są szczególnie istotne dla pacjentów z rakiem. Promieniowanie jonizujące, szeroko stosowane w leczeniu raka, często prowadzi do bolesnych urazów skóry dla prawie wszystkich pacjentów poddawanych radioterapii. To zapalenie w komórkach skóry może poważnie wpłynąć na jakość życia. Biorąc pod uwagę, że większość pacjentów z rakiem jest podatna na uszkodzenie skóry wywołane promieniowaniem, badania te mogą zapewnić bardzo potrzebną ulgę, potencjalnie torując drogę do skutecznych opcji leczenia.
Nieoczekiwanie badanie ujawniło również równowagę białka pomocniczego o nazwie jednoliciowe białko wiążące DNA 1 lub SSBP1, które ogranicza ruch IRF1 do jądra komórkowego i ogranicza jego aktywację. Kiedy poziomy SSBP1 spadły, IRF1 częściej osiągnął jądro, co prowadzi do większego stanu zapalnego i śmierci komórki. To odkrycie podkreśla, w jaki sposób istotne białka, takie jak SSBP1, pomagają kontrolować reakcje stresu w komórkach, spowolniając aktywację IRF1 i potencjalnie chroniąc komórki przed nadmiernym zapaleniem.
Oprócz tych odkryć naukowcy badali potencjalne terapie, identyfikując dwa inhibitory małych cząsteczek, które konkretnie ograniczają aktywację IRF1. Wczesne testy tych związków są obiecujące w zmniejszaniu stanu zapalnego i uszkodzeń promieniowania, co czyni ich nadziei kandydatów do zastosowania klinicznego w celu ułatwienia działań niepożądanych wywołanych promieniowaniem. Przy dalszych testach inhibitory te można dodać do zakresu leczenia dostępnych do zarządzania uszkodzeniem promieniowania u pacjentów, zwłaszcza tych poddawanych terapii przeciwnowotworowej.
Co ciekawe, badania te przecinają się również z badaniem infekcji wirusowych. Wykazano, że wirus SARS-COV-2, który powoduje COVID-19, wywołuje podobne zapalenie oparte na IRF1 w komórkach. Odkrycia zespołu sugerują, że białka wirusowe z SARS-COV-2 mogą aktywować IRF1 w taki sam sposób, jak promieniowanie, co prowadzi do porównywalnego procesu zapalnego. Ich analiza wykazała, że w szczególności wirusowe białko NSP-10 odgrywa rolę w aktywacji IRF1, potencjalnie przyczyniając się do uszkodzenia tkanek obserwowanych w ciężkich przypadkach Covid-19. Obiecując, wykazano również, że inhibitory małych cząsteczek zidentyfikowane w tym badaniu tłumią aktywację IRF1 związaną z SARS-COV-2, wskazując na ich szerszy potencjał w leczeniu stanu zapalnego z wielu przyczyn.
Nowe terapie mogą pewnego dnia koncentrować się na lekach, które blokują lub ograniczają aktywację IRF1, oferując obiecujące podejście dla chronienia pacjentów przed długoterminowym zapalnym działaniem radioterapii. Dzięki zerowym modyfikacjom chemicznym i działaniu białek pomocniczych, które kontrolują IRF1, naukowcy mają nadzieję zapobiec niektórym szkodom komórkowym związanym z powtarzającym się ekspozycją na promieniowanie, jak widać w leczeniu medycznym.
Badanie to zapewnia nowe zrozumienie, w jaki sposób komórki strukturalne przyczyniają się do stanu zapalnego pod stresem, torując drogę do leczenia przeciwzapalnego, które mogłyby pomóc nie tylko osobom dotkniętym promieniowaniem, ale także osobom z takimi stanami takimi jak COVID-19, w których mogą wystąpić podobne reakcje zapalne. Zespół, kierowany przez profesora Shuyu Zhanga, wybitnego naukowca w zakresie badań promieniowania jądrowego, poczynił znaczne postępy w wyjaśnieniu roli IRF1 w ochronie komórek i kontroli szkód. Praca profesora Zhanga w dziedzinie biologii promieniowania i stanu zapalnego, odzwierciedlona w ponad 150 opublikowanych artykułach, znacznie rozwinęła zrozumienie uszkodzenia radiogenicznego i opcji leczenia pacjentów stojących przed skutkami ubocznymi promieniowania.
Referencje dziennika
Geng F, Chen J, Song B, i in., „Aktywacja za pośrednictwem opiekuńczy i PTM i IRF1 TAMES TAMES ŚMIERNIK Komórki i odpowiedź zapalna”. Immunologia komórkowa i molekularna, 2024. DOI: https://doi.org/10.1038/S41423-024-01185-3