Uzupełniające się białka odgrywają istotną rolę w naszym układzie odpornościowym, pomagając naszym ciałom odeprzeć infekcje. Jednak dokładny sposób, w jaki białka te oddziałują ze specyficznymi receptorami komórkowymi, od dawna jest przedmiotem intryg naukowych. Nowe badania rzucają światło na to, jak uzupełniające się białka wiążą się z izoformami CR2, potencjalnie torując drogę do postępów w leczeniu chorób związanych z odpornością.
Ostatnie badania oświetlały fascynujące wgląd w interakcje między parami białkami uzupełniającymi a izoformami CR2. Badanie to, przeprowadzone przez Giuseppe Barile z Istituto Tecnologie Biomediche, CNR, Włochy, zagłębia się w złożone mechanizmy biochemiczne rządzące tymi interakcjami. Prace są publikowane w czasopiśmie Biochemistry and Biophysics Reports.
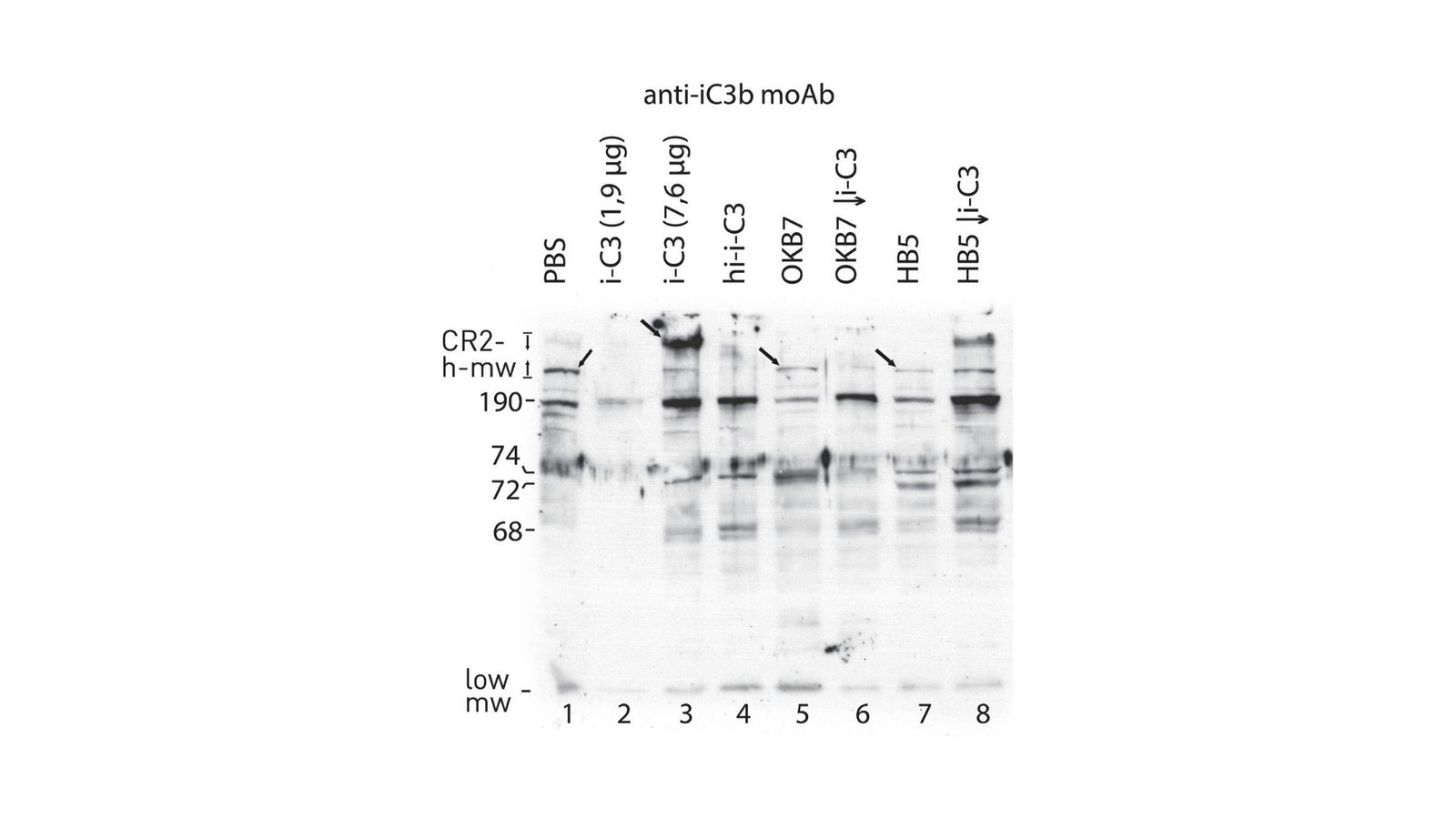
Receptor receptora typu 2 (CR2), znany również jako CD21, jest kluczową transmembranową glikoproteiną wyrażaną głównie na komórkach B. CR2 służy jako receptor C3D, fragment komponentu dopełniacza C3, który odgrywa znaczącą rolę w odpowiedzi immunologicznych. Badanie podkreśla, że komórki Raji, linia komórkowa CR2-dodatni, mogą wiązać zarówno endogenne, jak i egzogeniczne formy I-C3, co powoduje powstawanie heterodimerów połączonych za pomocą wiązań tioestera. Odkrycia te mają głębokie implikacje dla zrozumienia aktywacji komórek odpornościowych i interakcji patogenów.
Giuseppe Barile wyjaśnia: „Nasze badanie pokazuje, że utrwalenie I-C3 do CR2 obejmuje misterne mechanizmy, na które wpływ mają właściwości hydrofobowe specyficznych reszt aromatycznych obecnych w strukturze C3C I-C3”.
Barile zastosowała szereg badań wiązania i technik immunoblottingu, aby odkryć, w jaki sposób różne mechanizmy rozszczepienia mogą mieć znaczący wpływ obecność określonych przeciwciał monoklonalnych (MOAB), takich jak OKB7 i HB5.
Badanie wykazało, że komórki Raji nie tylko wiążą egzogenne I-C3, ale także wewnętrznie syntetyzują białko podobne do C3, które Barile odnosi się do E-C3. Białko to, o pewnych cechach podobnych do I-C3, jest niezbędne dla funkcji odpornościowych komórek i jest zaangażowane w tworzenie złożonych struktur z CR2, potencjalnie odgrywając rolę w autokrynnej sygnalizacji.
Co ciekawe, badanie podkreśliło również rolę cząsteczek o niskiej masie cząsteczkowej w tych interakcjach. „Te cząsteczki wydają się silnie wiązać jednostki kompleksu immunologicznego przez Tioester, nadając pozorną stabilność kompleksom Cr2-C3”. „Jest prawdopodobne, że kompleksy immunologiczne usieciowane przez wiele miejsc wiązania (co najmniej trzy) przez określony ABS (lub kompleksy ABS) może cierpieć pęknięcia w ich strukturach, umożliwiając wejście H2O, które hydrolizuje tioestrów. W rezultacie antygen guza powierzchniowego nie jest już powlekany i dlatego można go rozpoznać przez układ odpornościowy, który może fizycznie zabić komórkę nowotworową. Podobny mechanizm powinien zatem leżeć leżącym u podstaw sukcesu immunoterapii w niektórych guzach. ”
„Nasze ustalenia sugerują, że hydrofobowość niektórych reszt w C3C jest niezbędna do utrwalenia I-C3 do CR2”, zauważa Barile. „Może to utorować drogę do nowych strategii terapeutycznych ukierunkowanych na te interakcje w chorobach odpornościowych”.
Implikacje tych ustaleń są znaczące. Rozumiejąc szczegółowe informacje o tym, w jaki sposób CR2 oddziałuje z białkami dopełniaczowymi, naukowcy mogą lepiej docenić leżące u podstaw mechanizmy aktywacji i regulacji komórek odpornościowych. Ta wiedza jest niezbędna do opracowywania ukierunkowanych terapii chorób autoimmunologicznych i poprawy odpowiedzi immunologicznej na infekcje.
Barile stosowała zaawansowane techniki, takie jak SDS-PAGE i immunoblotting w celu wizualizacji interakcji między fragmentami CR2 i C3. Jego skrupulatne podejście pozwoliło mu zidentyfikować określone pasma białkowe odpowiadające tym interakcjom, dodatkowo wyjaśniając strukturalne aspekty kompleksów Cr2-C3.
Podsumowując, badania przeprowadzone przez Giuseppe Barile zapewniają krytyczne wgląd w interakcje biochemiczne między białkami CR2 i dopełniaczami. Jego praca podkreśla znaczenie określonych cech molekularnych w tych interakcjach i otwiera nowe możliwości interwencji terapeutycznej w zaburzeniach związanych z odpornością.
Referencje dziennika
Barile, G. (2024). „Połączenie par białek dopełniacza z izoformami CR2”. Raporty biochemii i biofizyki, 38, 101657. DOI: https://doi.org/10.1016/j.bbrep.2024.101657
O autorze
Giuseppe Barile Urodził się 23 sierpnia 1946 r. W Cercemaggiore, Molise, Włochy, ukończył nauki biologiczne w 1971 roku. Odbiorca stypendium CNR w 1973 r., Begam Research in Estrogen i Progestin Receptors, później rozszerzając swój skupienie na wirusologię i immunologię z 1982 r. Wizytujący badacz w laboratorium biochemii hormonalnej, ICRF, Londyn, dyrektor dr Jrb King i Department of Radiobiology, Sztokholm University, dyrektor dr Gunnar ähnstrom. Przyznał stypendium od AIRC (wrzesień 1983/AG.84), odbył urlop na studiach, aby zbadać Departament Immunologii w szpitalu S. Justine, Montreal, Kanada, kierowany przez dr J. Menezesa. Przyczynił się, wraz z innymi badaczami do opracowywania 37 prac opublikowanych w czasopismach naukowych. W 2009 roku przeszedł na emeryturę jako Dirigente di Ricerca w ITBM, CNR, kończąc wybitną karierę.