Anaplastyczne chłoniak o dużych komórkach (ALCL), rodzaj agresywnego chłoniaka komórek T CD30+, stanowi ogromne wyzwanie w onkologii ze względu na złożone genetyczne podstawy i oporność na konwencjonalne terapie. Naukowcy prowadzeni przez profesora Thomasa spojrzenia na Dana-Farber Cancer Institute i Boston Children’s Hospital wyjaśnili kluczowe mechanizmy w patologii Alcl, zapewniając potencjalną ścieżkę terapii ukierunkowanych. Ich odkrycia, opublikowane w Cell Reports Medicine, ujawniają, w jaki sposób STAT3, kluczowe białko sygnalizacyjne, integruje się z rdzeniowymi regulatorami transkrypcyjnymi, aby utrzymać stan złośliwy w ALCL.
Zespół badawczy, w tym dr Nicole Prutsch, dr Brian Abraham, dr Mark Zimmerman i współpracownicy, wyruszyli w to badanie, aby zrozumieć precyzyjną rolę STAT3 w ALCL. Ich wspólne wysiłki obejmowały instytucje, w tym St. Jude Children’s Research Hospital, University of Cambridge i Medical University of Wiedeń, a także Dana Farber Cancer Institute. Badanie zostało opublikowane w recenzowanym czasopiśmie Cell Reports Medicine.
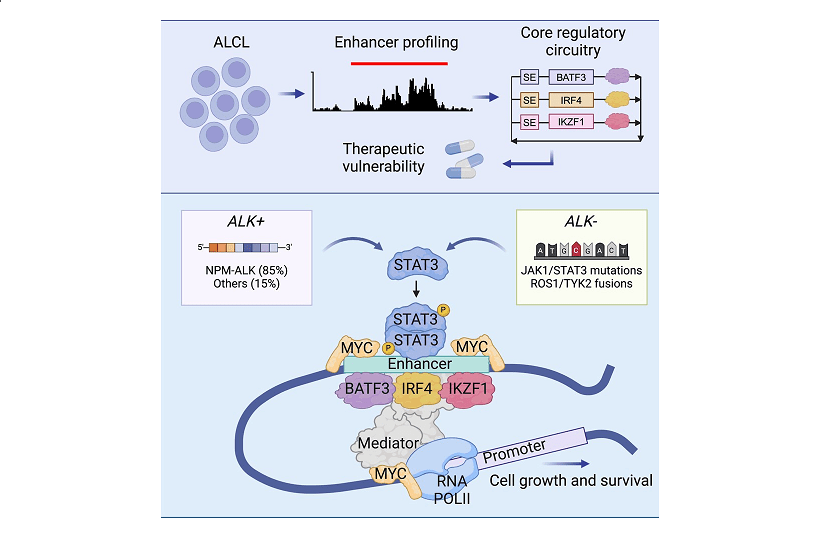
ALCL jest często napędzane przez rearanżacje chromosomalne, które aktywują kinazę tyrozynową alk lub inne mutacje, które prowadzą do ciągłej aktywacji szlaku sygnałowego JAK-STAT. Profesor Look i jego zespół odkryli, że w komórkach ALCL ACTYIVED STAT3 wiąże się z innymi kluczowymi czynnikami transkrypcyjnymi – BATF3, IRF4 i IKZF1 – aby utworzyć podstawowy obwód regulacyjny (CRC), który promuje przeżycie i proliferację komórek rakowych. „Nasze badania wykazały, że komórki ALCL są wysoce zależne od niewielkiej grupy podstawowych czynników transkrypcyjnych regulacyjnych. Kierowanie tych zależności otwiera nowe możliwości interwencji terapeutycznej ” – powiedział dr Zimmerman.
Zespół zastosował sekwencjonowanie immunoprecypitacji chromatyny (ChIP-SEQ) do mapowania regionów wzmacniacza w komórkach ALCL, identyfikując konserwowany zestaw super-losów związanych z genami takimi jak BATF3, IRF4 i IKZF1. Regiony te zostały bardzo wzbogacone dla H3K27AC, charakterystyczne modyfikacji histonów dla aktywnych wzmacniaczy, podkreślając rolę czynników transkrypcyjnych kodowanych przez te geny w napędzaniu wysokich poziomów ekspresji rozszerzonego programu genu krytycznego dla złośliwego fenotypu. Ponadto analiza obłożenia całego genomu wykazała, że STAT3, po aktywacji przez kinazę ALK, współpracuje z tymi czynnikami transkrypcyjnymi CRC u super-wznisk, zapewniając trwałą ekspresję genów onkogennych.
W badaniu podkreśliło, że STAT3, choć nie spełnia typowych kryteriów komponentu CRC z powodu braku super-losu napędzającego jego ekspresję, odgrywa kluczową rolę jako czynnik transkrypcyjny reagujący na sygnał. Po aktywacji przez sygnalizację kinazy tyrozynowej STAT3 działa w tandemie z CRC w celu regulacji ekspresji MYC, dobrze znanego onkogenu. „Nasze ustalenia sugerują, że STAT3, wraz z czynnikami transkrypcyjnymi CRC, napędza onkogenny program ekspresji genów w ALCL”, zauważył dr Abraham.
Profesor spojrzenie podkreślił długoterminowe znaczenie swoich badań, stwierdzając: „Moje laboratorium odkryło gen ALK i gen fuzji NPM-ALK w 1994 r., Który zapewnia aktywowaną sygnalizę kinazy tyrozynowej, która aktywuje STAT3, jak podkreślono w naszych badaniach zgłoszonych w bieżącym papierze 30 lat później, zapewniając kluczowy mechanizm transformacji transformacji.
W testach funkcjonalnych naukowcy wykazali, że zakłócenie dowolnego pojedynczego składnika CRC znacznie upośledza wzrost i żywotność komórek ALCL. W szczególności degradacja farmakologiczna IKZF1 doprowadziła do zmniejszenia wzrostu komórek, podkreślając jego istotną rolę w regulacji w górę CRC, która jest niezbędna do proliferacji i przeżycia komórek ALCL. Ponadto zespół wykazał, że inhibitory STAT3, takie jak STAT3-in-3 i stattic, skutecznie zmniejszają żywotność komórek ALCL, a ich połączenie z degraderami IKZF1 dały jeszcze bardziej znaczące działanie przeciwnowotworowe.
Jednym z krytycznych spostrzeżeń badania była interakcja między STAT3 i MYC. Korzystając z SEQ CHIP, naukowcy stwierdzili, że STAT3 wiąże się z regulacyjnymi regionami regulacyjnymi genu MYC, które wytwarza wysokie poziomy białka MYC, które następnie współpracuje z czynnikami transkrypcyjnymi CRC w celu utrzymania wysokich poziomów ekspresji MYC. Ta wzajemna gra podkreśla potencjał terapeutyczny ukierunkowanego na STAT3 w ALCL, szczególnie w przypadkach odpornych na inhibitory ALK. „Wykazując, że aktywacja STAT3 jest konieczna i wystarczająca do ekspresji MYC i przeżycia komórek alcl, zapewniamy silne uzasadnienie opracowywania terapii ukierunkowanych na STAT3”, dodał profesor Look.
Podsumowując, badanie to rzuca światło na skomplikowane sieci regulacyjne podtrzymujące ALCL i identyfikuje STAT3 jako linchpin w procesie onkogennym. Wspólne wysiłki zespołu badawczego utorowały drogę do nowych strategii terapeutycznych ukierunkowanych na połączone zależności transkrypcyjne w ALCL. Jak stwierdził profesor: „Nasza praca oferuje krytyczne wgląd w biologię molekularną Alcl, prowadząc przyszłe badania w kierunku bardziej skutecznych metod leczenia”.
Referencje dziennika
Prutsch, N., He, S., Berezovskaya, A., Durbin, Ad, Dharia, NV, Maher, Ka,… & Look, At (2024). STAT3 pary aktywowały sygnalizację kinazy tyrozynowej do onkogennego rdzenia transkrypcyjnego obwodu regulacyjnego chłoniaka anaplastycznego dużego komórki. Komórki raporty medycyny, 5 (101472). Doi: https://doi.org/10.1016%2FJ.xcrm.2024.101472
O autorze

Dana-Farber Cancer Institute
Profesor pediatrii
Harvard Medical School
Boston, Mass.
A. Thomas LookMD, jest profesorem pediatrii w Harvard Medical School i członkiem Wydziału Onkologii Pediatrii w Dana-Farber Cancer Institute. Look uzyskał studia MD i podyplomowe szkolenie w dziedzinie pediatrii na University of Michigan oraz szkolenie stypendialne w dziedzinie onkologii pediatrycznej w szpitalu badawczym dla dzieci w St. Jude, gdzie zajął się ponad dwadzieścia lat, aby zostać przewodniczącym Eksperymentalnego Wydziału Onkologicznego i profesora pediatrii na University of Tennessee College of Medicine. W 1999 r. Przeprowadził się ze szpitala badawczego dla dzieci St. Jude do Dana-Farber Cancer Institute i Harvard Medical School, aby ustanowić program badawczy w danio pręgowanym jako model raka ludzkiego.
W ciągu ostatnich czterech dekad Look opublikował 390 recenzowanych artykułów dotyczących molekularnych podstawy transformacji złośliwej, nieprawidłowej proliferacji i apoptozy w komórkach rakowych i zastosowaniu molekularnych wyników genetycznych w celu poprawy leczenia złośliwości dzieci i dorosłych, zwłaszcza białaczki Tucte Cell, aute-komórki T.
Look przeprowadził badania genetyczne mające na celu identyfikację nowych celów terapii przeciwnowotworowej, a teraz jest uznawany na arenie międzynarodowej jako lider w tej dziedzinie. Jego grupa odkryła anaplastyczny gen receptora tyrozynowego limfatynowego (ALK) w 1994 r. Patrz pokazał, że białaczkowe komórki T zawierają „podstawowe” sieci transkrypcyjne, które bardzo przypominają osoby kontrolujące pluripotencję zarodkowych komórek macierzystych. Niedawno Look i jego koledzy pokazali, że nabyli mutacje w kluczowym regionie wzmacniacza powyżej tal1 onkogenu tworzy nowe miejsca wiązania dla czynnika transkrypcyjnego MYB. Wiązanie MyB sprzyja wiązaniu innych członków kompleksu TAL1 i inicjuje super-wzbudzonego tal1 onkogenu, napędzając wysoki poziom ekspresji, która zakończy się T-ALL. Odkrycie to stanowi koncepcyjne ramy dla zrozumienia zdarzeń genetycznych, które przekształcają ludzkie tymocyty i opracowywać skuteczne strategie zindywidualizowanej terapii.
Ponadto jego laboratorium opracowało pierwsze transgeniczne modele danio pręgowanego ostrej białaczki limfoblastycznej limfoblastycznej i neuroblastaka dziecięcego, otwierając możliwość zastosowania potężnej technologii biologii genetycznej i chemicznej mające zastosowanie do modelu danio pręgowanego w celu zidentyfikowania nowych celów molekularnych i lekkich leków na leczenie w tych dzieciach. Jego laboratorium opracowało również pierwsze modele danio pręgowanego zespołu szpikowego i hematopoezę klonalną z powodu utraty TET2, ASXL1 i DNMT3A, których używa do identyfikacji leków, które selektywnie ukierunkowały zmutowane łodygi krwiotwórcze i progenitorowe, podczas gdy oszczędzają normalną hematopoiesis.